Электрический ток в жидкостях. Движение зарядов, анионы катионы
Электронный ток в жидкостях
В железном проводнике электронный ток появляется направленным движением свободных электронов и что при всем этом никаких конфигураций вещества, из которого проводник изготовлен, не происходит.
Такие проводники, в каких прохождение электронного тока не сопровождается хим переменами их вещества, именуются проводниками первого рода . К ним относятся все металлы, уголь и ряд других веществ.
Но есть в природе и такие проводники электронного тока, в каких во время прохождения тока происходят хим явления. Эти проводники именуются проводниками второго рода . К ним относятся приемущественно разные смеси в воде кислот, солей и щелочей.
Если в стеклянный сосуд налить воды и прибавить в нее несколько капель серной кислоты (либо какой-нибудь другой кислоты либо щелочи), а потом взять две железные пластинки и присоединить к ним проводники опустив эти пластинки в сосуд, а к другим концам проводников подключить источник тока через выключатель и амперметр, то произойдет выделение газа из раствора, при этом оно будет длиться безпрерывно, пока замкнута цепь т.к. подкисленная вода вправду является проводником. Не считая того, пластинки начнут покрываться пузырьками газа. Потом эти пузырьки будут отрываться от пластинок и выходить наружу.
При прохождении по раствору электронного тока происходят хим конфигурации, в итоге которых выделяется газ.
Проводники второго рода именуются электролитами , а явление, происходящее в электролите при прохождении через него электронного тока, - .
Железные пластинки, опущенные в электролит, именуются электродами; одна из их, соединенная с положительным полюсом источника тока, именуется анодом , а другая, соединенная с отрицательным полюсом,- катодом .
Чем все-таки обусловливается прохождение электронного тока в водянистом проводнике? Оказывается, в таких смесях (электролитах) молекулы кислоты (щелочи, соли) под действием растворителя (в этом случае воды) распадаются на две составные части, при этом одна частичка молекулы имеет положительный электронный заряд, а другая отрицательный.
Частички молекулы, владеющие электронным зарядом, именуются ионами . При растворении в воде кислоты, соли либо щелочи в растворе появляется огромное количество как положительных, так и отрицательно заряженных ионов.
Сейчас должно стать понятным, почему через раствор прошел электронный ток, ведь меж электродами, соединенными с источником тока, сотворена разность потенциалов, по другому говоря, какой-то из них оказался заряженным положительно, а другой негативно. Под действием этой разности потенциалов положительные ионы начали перемешаться по направлению к отрицательному электроду - катоду, а отрицательные ионы - к аноду.
Таким макаром, хаотическое движение ионов стало упорядоченным встречным движением отрицательно заряженных ионов в одну сторону и положительных в другую. Этот процесс переноса зарядов и составляет течение электронного тока через электролит и происходит до того времени, пока имеется разность потенциалов на электродах. С исчезновением разности потенциалов прекращается ток через электролит, нарушается упорядоченное движение ионов, и вновь наступает хаотическое движение.
В качестве примера разглядим явление электролиза при пропускании электронного тока через раствор медного купороса CuSO4 с опущенными в него медными электродами.

Явление электролиза при прохождении тока через раствор медного купороса: С — сосуд с электролитом, Б - источник тока, В - выключатель
Тут также будет встречное движение ионов к электродам. Положительным ионом будет ион меди (Си), а отрицательным - ион кислотного остатка (SO4). Ионы меди при соприкосновении с катодом будут разряжаться (присоединяя к для себя недостающие электроны), т. е. преобразовываться в нейтральные молекулы незапятанной меди, и в виде тончайшего (молекулярного) слоя отлагаться на катоде.
Отрицательные ионы, достигнув анода, также разряжаются (отдают лишние электроны). Но при всем этом они вступают в хим реакцию с медью анода, в итоге чего к кислотному остатку SO4 присоединяется молекула меди Сu и появляется молекула медного купороса СuS О4 , возвращаемая назад электролиту.
Потому что этот хим процесс протекает долгое время, то на катоде отлагается медь, выделяющаяся из электролита. При всем этом электролит заместо ушедших на катод молекул меди получает новые молекулы меди за счет растворения второго электрода - анода.
Тот же самый процесс происходит, если заместо медных взяты цинковые электроды, а электролитом служит раствор цинкового купороса Zn SO4. Цинк также будет переноситься с анода на катод.
Таким макаром, разница меж электронным током в металлах и водянистых проводниках состоит в том, что в металлах переносчиками зарядов являются только свободные электроны, т. е. отрицательные заряды, тогда как в электролитах электричество переносится разноименно заряженными частичками вещества - ионами, двигающимися в обратных направлениях. Потому молвят, что электролиты владеют ионном проводимостью.

Явление электролиза было открыто в 1837 г. Б. С. Якоби, который создавал бессчетные опыты по исследованию и усовершенствованию хим источников тока. Якоби установил, что один из электродов, помещенных в раствор медного купороса, при прохождении через него электронного тока покрывается медью.
Это явление, нареченное гальванопластикой , находит на данный момент очень огромное практическое применение. Одним из примеров тому может служить покрытие железных предметов узким слоем других металлов, т. е. никелирование, золочение, серебрение и т. д.
Газы (в том числе и воздух) в обыденных критериях не проводят электронный ток. К примеру, нагие провода воздушных линий, будучи подвешены параллельно друг дружке, оказываются изолированными один от другого слоем воздуха.
Но под воздействием высочайшей температуры, большой разности потенциалов и других обстоятельств газы, подобно водянистым проводникам, ионизируются , т. е. в их возникают в большенном количестве частички молекул газа, которые, являясь переносчиками электричества, содействуют прохождению через газ электронного тока.
Но совместно с тем ионизация газа отличается от ионизации водянистого проводника. Если в воды происходит распад молекулы на две заряженные части, то в газах под действием ионизации от каждой молекулы всегда отделяются электроны и остается ион в виде положительно заряженной части молекулы.
Стоит только закончить ионизацию газа, как он закончит быть проводящим, тогда как жидкость всегда остается проводником электронного тока. Как следует, проводимость газа - явление временное, зависящее от деяния наружных обстоятельств.

Но есть и другой вид разряда, именуемый дуговым разрядом либо просто электронной дугой. Явление электронной дуги было открыто сначала 19-го столетия первым русским электротехником В. В. Петровым.
В. В. Петров, проделывая бессчетные опыты, нашел, что меж 2-мя древесными углями, соединенными с источником тока, появляется непрерывный электронный разряд через воздух, сопровождаемый броским светом. В собственных трудах В. В. Петров писал, что при всем этом «черный покой довольно ярко освещен может быть». Так в первый раз был получен электронный свет, фактически применил который очередной российский ученый-электротехник Павел Николаевич Яблочков.
«Свеча Яблочкова», работа которой базирована на использовании электронной дуги, сделала в те времена реальный переворот в электротехнике.

Дуговой разряд применяется как источник света и в наши деньки, к примеру в прожекторах и проекционных аппаратах. Высочайшая температура дугового разряда позволяет использовать его для устройства дуговой печи. В текущее время дуговые печи, питаемые током очень большой силы, используются в ряде областей индустрии: для выплавки стали, чугуна, ферросплавов, бронзы и т.д. А в 1882 году Н. Н. Бенардосом дуговой разряд в первый раз был применен для резки и сварки металла.
В газосветных трубках, лампах дневного света, стабилизаторах напряжения, для получения электрических и ионных пучков употребляется так именуемый тлеющий газовый разряд .
Искровой разряд применяется для измерения огромных разностей потенциалов при помощи шарового разрядника, электродами которого служат два железных шара с полированной поверхностью. Шары раздвигают, и на их подается измеряемая разность потенциалов. Потом шары сближают до того времени, пока меж ними не перескочит искра. Зная поперечник шаров, расстояние меж ними, давление, температуру и влажность воздуха, находят разность потенциалов меж шарами по особым таблицам. Этим способом можно определять с точностью до нескольких процентов разности потенциалов порядка 10-ов тыщ вольт.
Это пока все. Ну а если Вы желаете выяснить больше, то рекомендую направить внимание на диск Миши Ванюшина:
«Про электричество для начинающих в видео формате на DVD-диске»
Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. В этом уроке речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников - ионный.
Определение . Проводники второго рода - такие проводники, в которых при протекании тока происходят химические процессы.
Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество - поваренной соли - и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).

Рис. 1. Схема опыта
Проводимость электролитов
Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики - полярные. Вода имеет как раз-таки полярные молекулы (рис. 2).

Рис. 2. Полярность молекулы воды
При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные - возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора - отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.

Рис. 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои.
Электролиз
Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза.
Определение. Электролиз - процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей (рис. 4).
Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия.
Законы Фарадея
В первой работе по электролизу 1833 года Фарадей представил свои два закона электролиза. В первом речь шла о массе вещества, выделяющегося на электродах:
Первый закон Фарадея гласит, что эта масса пропорциональна заряду, прошедшему через электролит:
Здесь роль коэффициента пропорциональности играет величина - электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
![]()
Физический смысл электрохимического эквивалента - масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
Если вспомнить формулы из темы о постоянном токе:
То можно представить первый закон Фарадея в виде:
Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:
Здесь: - молярная масса электролита; - элементарный заряд; - валентность электролита; - число Авогадро.
Величина называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
Исходя из второго закона Фарадея, первый закон можно представить в виде:
![]()
Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду.
Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией.
Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы.
Практическое применение электролиза
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия - покрытие одного металла другим (хромирование, никелирование, золочение и т.д., рис. 5)
- Fatyf.narod.ru ().
- ХиМиК ().
- Ens.tpu.ru ().
Домашнее задание
- Что такое электролиты?
- Какие существуют два принципиально разных типа жидкостей, в которых может протекать электрический ток?
- Какие могут быть механизмы образования свободных носителей зарядов?
- *Почему масса, выделившаяся на электроде, пропорциональна заряду?
Электрический ток в газах
Носители заряда: электроны, положительные ионы, отрицательные ионы.
Носители заряда возникают в газе в результате ионизации: вследствие облучения газа, либо столкновений частиц нагретого газа друг с другом.
Ионизация электронным ударом.
A_{поля}=eEl
e=1,6\cdot 10^{19}Кл ;
E - направление поля;
l - длина свободного пробега между двумя последовательными столкновениями электрона с атомами газа.
A_{поля}=eEl\geq W - условие ионизации
W - энергия ионизации, т.е. энергия, необходимая для того, чтобы вырвать из атома электрон

Число электронов увеличивается в геометрической прогрессии, в результате возникает электронная лавина, а следовательно разряд в газе.
Электрический ток в жидкости
Жидкости так же, как и твердые тела могут быть диэлектриками, проводниками и полупроводниками. К числу диэлектриков относится дистиллированная вода, к проводникам - растворы электролитов: кислот, щелочей, солей и расплавы металлов. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов.
Электролитическая диссоциация
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы. Например, CuSO_{4}\rightarrow Cu^{2+}+SO^{2-}_{4} .
Наряду с диссоциацией идет обратный процесс - рекомбинация , т.е. объединение ионов противоположных знаков в нейтральные молекулы.
Носителями электричества в растворах электролитов являются ионы. Такая проводимость называется ионной .
Электролиз
Если в ванну с раствором электролита поместить электроды и пустить ток, то отрицательные ионы будут двигаться к положительному электроду, а положительные - к отрицательному.
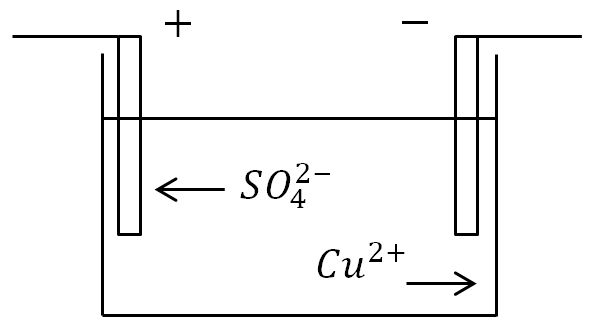
На аноде (положительном электроде) отрицательно заряженные ионы отдают лишние электроны (окислительная реакция), а на катоде (отрицательном электроде) положительные ионы получают недостающие электроны (восстановительная реакция).
Определение. Процесс выделения на электродах веществ, связанный с окислительно-восстановительными реакциями называется электролизом.
Законы Фарадея
I. Масса вещества, которая выделяется на электроде, прямо пропорциональна заряду, протекшему через электролит:
m=kq
k - электрохимический эквивалент вещества.
q=I\Delta t , тогда
m=kI\Delta t
k=\frac{1}{F}\frac{\mu}{n}
\frac{\mu}{n} - химический эквивалент вещества;
\mu - молярная масса;
n - валентность
Электрохимические эквиваленты веществ пропорциональны химическим.
F - постоянная Фарадея;
В отношении своих электрических свойств жидкости отличаются большим многообразием. Расплавленные металлы, как и металлы в твердом состоянии, имеют высокую электропроводность, связанную с большой концентрацией свободных электронов.
Многие жидкости, например чистая вода, спирт, керосин, являются хорошими диэлектриками, поскольку их молекулы электронейтральны и в них отсутствуют свободные носители заряда.
Электролиты. Особый класс жидкостей составляют так называемые электролиты, к которым относятся водные растворы неорганических кислот, солей и оснований, расплавы ионных кристаллов и т. д. Для электролитов характерно наличие высоких концентраций ионов, обусловливающих возможность прохождения электрического тока. Эти ионы возникают при плавлении и при растворении, когда под влиянием электрических полей молекул растворителя происходит разложение молекул растворяемого вещества на отдельные положительно и отрицательно заряженные ионы. Такой процесс называется электролитической диссоциацией.
Электролитическая диссоциация. Степень диссоциации а данного вещества, т. е. доля молекул растворенного вещества, распавшихся на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. С увеличением температуры степень диссоциации растет. Ионы противоположных знаков могут рекомбинировать, объединяясь снова в нейтральные молекулы. При неизменных внешних условиях в растворе устанавливается динамическое равновесие, при котором процессы рекомбинации и диссоциации компенсируют друг друга.
Качественно зависимость степени диссоциации а от концентрации растворенного вещества можно установить с помощью следующих простых рассуждений. Если в единице объема содержится молекул растворенного вещества, то из них диссоциированы, а остальные не диссоциированы. Число элементарных актов диссоциации в единице объема раствора пропорционально числу нерасщепленных молекул и поэтому равно где А - коэффициент, зависящий от природы электролита и температуры. Число актов рекомбинации пропорционально числу соударений разноименных ионов, т. е. пропорционально числу как тех, так и других ионов. Поэтому оно равно где В - коэффициент, постоянный для данного вещества при определенной температуре.
В состоянии динамического равновесия
![]()
Отношение не зависит от концентрации Видно, что чем меньше концентрация раствора, тем а ближе к единице: в очень разбавленных растворах практически все молекулы растворенного вещества диссоциированы.
Чем выше диэлектрическая проницаемость растворителя, тем больше ослабляются ионные связи в молекулах растворенного вещества и, следовательно, тем больше степень диссоциации. Так, соляная кислота дает электролит с высокой электропроводностью при растворении в воде в то время как ее раствор в этиловом эфире очень плохо проводит электрический ток.
Необычные электролиты. Встречаются и весьма необычные электролиты. Например, электролитом является стекло, представляющее собой сильно переохлажденную жидкость, обладающую громадной вязкостью. При нагревании стекло размягчается и его вязкость сильно уменьшается. Присутствующие в стекле ионы натрия приобретают заметную подвижность, и становится возможным прохождение электрического тока, хотя при обычных температурах стекло является хорошим изолятором.

Рис. 106. Демонстрация электропроводности стекла при нагревании
Наглядной демонстрацией этого может служить опыт, схема которого показана на рис. 106. Стеклянная палочка включена в осветительную сеть через реостат Пока палочка холодная, ток в цепи ничтожный из-за высокого сопротивления стекла. Если палочку нагреть газовой горелкой до температуры 300-400 °С, то ее сопротивление упадет до нескольких десятков омов и нить лампочки Л раскалится. Теперь можно закоротить лампочку ключом К. При этом сопротивление цепи уменьшится и сила тока возрастет. В таких условиях палочка будет эффективно нагреваться электрическим током и раскаляться до яркого свечения, даже если убрать горелку.
Ионная проводимость. Прохождение электрического тока в электролите описывается законом Ома
Электрический ток в электролите возникает при сколь угодно малом приложенном напряжении.
Носителями заряда в электролите являются положительно и отрицательно заряженные ионы. Механизм электропроводности электролитов во многом сходен с описанным выше механизмом электропроводности газов. Основные отличия связаны с тем, что в газах сопротивление движению носителей заряда обусловлено главным образом их столкновениями с нейтральными атомами. В электролитах подвижность ионов обусловлена внутренним трением - вязкостью - при их движении в растворителе.
При повышении температуры проводимость электролитов, в противоположность металлам, увеличивается. Это связано с тем, что с ростом температуры возрастает степень диссоциации и уменьшается вязкость.
В отличие от электронной проводимости, характерной для металлов и полупроводников, где прохождение электрического тока не сопровождается каким бы то ни было изменением химического состава вещества, ионная проводимость связана с переносом вещества
и выделением на электродах веществ, входящих в состав электролитов. Такой процесс называется электролизом.
Электролиз. При выделении вещества на электроде уменьшается концентрация соответствующих ионов в примыкающей к электроду области электролита. Тем самым здесь нарушается динамическое равновесие между диссоциацией и рекомбинацией: именно здесь происходит разложение вещества в результате электролиза.
Электролиз впервые наблюдался в при разложении воды током от вольтова столба. Через несколько лет знаменитый химик Г. Дэви открыл натрий, выделив его путем электролиза из едкого натра. Количественные законы электролиза были экспериментально установлены М. Фарадеем в Их легко обосновать исходя из механизма явления электролиза.
Законы Фарадея. Каждый ион обладает электрическим зарядом, кратным элементарному заряду е. Другими словами, заряд иона равен , где - целое число, равное валентности соответствующего химического элемента или соединения. Пусть при прохождении тока на электроде выделилось ионов. Их заряд по абсолютной величине равен Положительные ионы достигают катода и их заряд нейтрализуется электронами, притекающими к катоду по проводам от источника тока. Отрицательные ионы подходят к аноду и такое же количество электронов уходит по проводам к источнику тока. При этом по замкнутой электрической цепи проходит заряд
Обозначим через массу вещества, выделившегося на одном из электродов, а через массу иона (атома или молекулы). Очевидно, что , следовательно, Умножив числитель и знаменатель этой дроби на постоянную Авогадро получим
где - атомная или молярная масса, постоянная Фарадея, определяемая выражением
Из (4) видно, что постоянная Фарадея имеет смысл «одного моля электричества», т. е. это суммарный электрический заряд одного моля элементарных зарядов:
Формула (3) содержит оба закона Фарадея. Она говорит о том, что масса выделившегося при электролизе вещества пропорциональна прошедшему по цепи заряду (первый закон Фарадея):
Коэффициент называется электрохимическим эквивалентом данного вещества и выражается в
килограммах на кулон Он имеет смысл обратной величины удельного заряда иона.
Электрохимический эквивалент к пропорционален химическому эквиваленту вещества (второй закон Фарадея).
Законы Фарадея и элементарный заряд. Поскольку во времена Фарадея представления об атомарной природе электричества еще не существовало, экспериментальное открытие законов электролиза было далеко не тривиальным. Напротив, именно законы Фарадея послужили по существу первым экспериментальным доказательством справедливости этих представлений.
Измерение на опыте постоянной Фарадея позволило в впервые получить числовую оценку значения элементарного заряда задолго до прямых измерений элементарного электрического заряда в опытах Милликена с масляными каплями. Замечательно, что идея атомарной структуры электричества получила недвусмысленное экспериментальное подтверждение в опытах по электролизу, выполненных в 30-е годы XIX века, когда даже идея атомарного строения вещества еще не разделялась всеми учеными. В знаменитой речи, произнесенной в Королевском обществе и посвященной памяти Фарадея, Гельмгольц таким образом комментировал это обстоятельство:
«Если мы признаем существование атомов химических элементов, то мы не можем избежать и дальнейшего заключения, что электричество, как положительное, так и отрицательное, разделено на определенные элементарные количества, которые ведут себя как атомы электричества».
Химические источники тока. Если какой-либо металл, например цинк, погрузить в воду, то некоторое количество положительных ионов цинка под влиянием полярных молекул воды начнет переходить из поверхностного слоя кристаллической решетки металла в воду. В результате цинк зарядится отрицательно, а вода положительно. На границе металла и воды образуется тонкий слой, называемый двойным электрическим слоем; в нем существует сильное электрическое поле, напряженность которого направлена от воды к металлу. Это поле препятствует дальнейшему переходу ионов цинка в воду, и в результате возникает динамическое равновесие, при котором среднее число ионов, приходящих из металла в воду, равно числу ионов, возвращающихся из воды в металл.
Динамическое равновесие установится и в том случае, если металл погрузить в водный раствор соли того же металла, например цинк в раствор цинкового купороса . В растворе соль диссоциирует на ионы Образовавшиеся при этом ионы цинка ничем не отличаются от ионов цинка, поступивших в раствор с электрода. Повышение концентрации ионов цинка в электролите облегчает переход этих ионов в металл из раствора и затрудняет
переход из металла в раствор. Поэтому в растворе цинкового купороса погруженный цинковый электрод хотя и заряжается отрицательно, но слабее, чем в чистой воде.
При погружении металла в раствор металл не всегда заряжается отрицательно. Например, если медный электрод погрузить в раствор медного купороса то ионы начнут из раствора осаждаться на электроде, заряжая его положительно. Напряженность поля в двойном электрическом слое в данном случае направлена от меди к раствору.
Таким образом, при погружении металла в воду или в водный раствор, содержащий ионы того же металла, на границе металла с раствором между ними возникает разность потенциалов. Знак и величина этой разности потенциалов зависит от типа металла (медь, цинк и т. от концентрации ионов в растворе и почти не зависит от температуры и давления.
Два электрода из разных металлов, погруженные в электролит, образуют гальванический элемент. Например, в элементе Вольта цинковый и медный электроды погружены в водный раствор серной кислоты. В первый момент раствор не содержит ни ионов цинка, ни ионов меди. Однако в дальнейшем эти ионы поступают в раствор с электродов и устанавливается динамическое равновесие. Пока электроды не соединены друг с другом проводом, потенциал электролита одинаков во всех точках, а потенциалы электродов отличаются от потенциала электролита благодаря образующимся Двойным слоям на их границе с электролитом. При этом электродный потенциал цинка равен -0,763 В, а меди Электродвижущая сила элемента Вольта, складывающаяся из этих скачков потенциалов, будет равна
Ток в цепи с гальваническим элементом. Если электроды гальванического элемента соединить проводом, то электроны по этому проводу будут переходить с отрицательного электрода (цинк) на положительный (медь), что нарушает динамическое равновесие между электродами и электролитом, в который они погружены. Ионы цинка начнут переходить с электрода в раствор, так чтобы поддерживать двойной электрический слой в прежнем состоянии с неизменным скачком потенциала между электродом и электролитом. Аналогично у медного электрода ионы меди начнут переходить из раствора и осаждаться на электроде. При этом около отрицательного электрода образуется недостаток ионов а у положительного - избыток таких ионов. Общее число ионов в растворе не изменится.
В результате описанных процессов в замкнутой цепи будет поддерживаться электрический ток, который в соединительном проводе создается движением электронов, а в электролите ионами. При прохождении электрического тока происходит постепенное растворение цинкового электрода и осаждение меди на положительном (медном)
электроде. Концентрация ионов увеличивается у цинкового электрода и уменьшается у медного.
Потенциал в цепи с гальваническим элементом. Описанная картина прохождения электрического тока в неоднородной замкнутой цепи, содержащей химический элемент, соответствует распределению потенциала вдоль цепи, схематически показанному на рис. 107. Во внешней цепи, т. е. в соединяющем электроды проводе потенциал плавно понижается от значения на положительном (медном) электроде А до значения на отрицательном (цинковом) электроде В в соответствии с законом Ома для однородного проводника. Во внутренней цепи, т. е. в электролите между электродами, потенциал плавно понижается от значения вблизи цинкового электрода до значения вблизи медного электрода. Если во внешней цепи ток идет от медного электрода к цинковому, то внутри электролита - от цинкового к медному. Скачки потенциалов в двойных электрических слоях создаются в результате действия сторонних (в данном случае химических) сил. Движение электрических зарядов в двойных слоях благодаря сторонним силам происходит против направления действия электрических сил.

Рис. 107. Распределение потенциала вдоль цепи, содержащей химический элемент
Наклонным участкам изменения потенциала на рис. 107 соответствуют электрические сопротивления внешнего и внутреннего участков замкнутой цепи. Суммарное падение потенциала вдоль этих участков равно сумме скачков потенциала в двойных слоях, т. е. электродвижущей силе элемента.
Прохождение электрического тока в гальваническом элементе осложняется побочными продуктами, выделяющимися на электродах, и появлением перепада концентрации в электролите. Об этих явлениях говорят как об электролитической поляризации. Например, в элементах Вольты при замыкании цепи положительные ионы движутся к медному электроду и осаждаются на нем. В результате через некоторое время медный электрод как бы заменяется водородным. Так как электродный потенциал водорода на 0,337 В ниже электродного потенциала меди, то ЭДС элемента уменьшается примерно на такую же величину. Кроме того, выделяющийся на медном электроде водород увеличивает внутреннее сопротивление элемента.
Для уменьшения вредного влияния водорода используются деполяризаторы - различные окислители. Например, в наиболее употребительном элементе Лекланше («сухие» батарейки)
положительным электродом служит графитовый стержень, окруженный спрессованной массой перекиси марганца и графита.
Аккумуляторы. Практически важной разновидностью гальванических элементов являются аккумуляторы, для которых после разрядки возможен обратный процесс зарядки с преобразованием электрической энергии в химическую. Вещества, расходуемые при получении электрического тока, восстанавливаются внутри аккумулятора путем электролиза.
Видно, что при зарядке аккумулятора повышается концентрация серной кислоты, что ведет к увеличению плотности электролита.
Таким образом, в процессе зарядки создается резкая асимметрия электродов: один становится свинцовым, другой - из перекиси свинца. Заряженный аккумулятор представляет собой гальванический элемент, способный служить источником тока.
При подключении к аккумулятору потребителей электрической энергии через цепь потечет электрический ток, направление которого противоположно зарядному току. Химические реакции идут в обратном направлении и аккумулятор возвращается в исходное состояние. Оба электрода будут покрыты слоем соли , а концентрация серной кислоты вернется к первоначальному значению.
У заряженного аккумулятора ЭДС составляет примерно 2,2 В. При разрядке она понижается до 1,85 В. Дальнейшую разрядку производить не рекомендуется, так как процесс образования сернокислого свинца становится необратимым и аккумулятор портится.
Максимальный заряд, который может отдать аккумулятор при разрядке, называется его емкостью. Емкость аккумулятора обычно
измеряется в ампер-часах. Она тем больше, чем больше поверхность пластин.
Применения электролиза. Электролиз используется в металлургии. Наиболее распространено электролитическое получение алюминия и чистой меди. С помощью электролиза можно создавать тонкие слои одних веществ на поверхности других с целью получения декоративных и защитных покрытий (никелирование, хромирование). Процесс получения отслаиваемых покрытий (гальванопластика) был разработан русским ученым Б. С. Якоби, применившим его для изготовления полых скульптур, украшающих Исаакиевский собор в Санкт-Петербурге.
Чем отличается физический механизм электропроводности в металлах и электролитах?
Поясните, почему степень диссоциации данного вещества зависит от диэлектрической проницаемости растворителя.
Объясните, почему в сильно разбавленных растворах электролита практически все молекулы растворенного вещества диссоциированы.
Поясните, в чем механизм электропроводности электролитов сходен с механизмом электропроводности газов. Почему при неизменных внешних условиях электрический ток пропорционален приложенному напряжению?
Какую роль при выводе закона электролиза (3) играет закон сохранения электрического заряда?
Поясните связь электрохимического эквивалента вещества с удельным зарядом его ионов.
Как можно на опыте определить отношение электрохимических эквивалентов разных веществ, если имеется несколько электролитических ванн, но нет приборов для измерения силы тока?
Каким образом явление электролиза можно использовать для создания счетчика расхода электроэнергии в сети постоянного тока?
Почему законы Фарадея можно рассматривать как экспериментальное доказательство представлений об атомарной природе электричества?
Какие процессы происходят при погружении металлических электродов в воду и в электролит, содержащий ионы этих металлов?
Опишите процессы, происходящие в электролите вблизи электродов гальванического элемента при прохождении тока.
Почему внутри гальванического элемента положительные ионы движутся от отрицательного (цинкового) электрода к положительному (медному) электроду? Каким образом в цепи возникает распределение потенциала, заставляющее ионы двигаться именно так?
Почему степень заряженности кислотного аккумулятора можно проверять при помощи ареометра, т. е. прибора для измерения плотности жидкости?
Чем в принципиальном отношении отличаются процессы в аккумуляторах от процессов в «сухих» батарейках?
Какая часть электрической энергии, затраченной в процессе зарядки аккумулятора с может быть использована при его разрядке, если в процессе зарядки аккумулятора на его клеммах поддерживалось напряжение
К жидкостям, являющимся проводниками, относятся расплавы и растворы электролитов, т.е. солей, кислот и щелочей.
При растворении электролитов в воде происходит распад их молекул на ионы – электролитическая диссоциация. Степень диссоциации, т.е. доля в растворенном веществе молекул, распавшихся на ионы, зависит от температуры, концентрации раствора и электрических свойств растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов. Ионы разных знаков при встрече могу снова объединиться в нейтральные молекулы. Такой процесс называется рекомбинация. При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Т.о., свободными носителями зарядов в проводящих жидкостях являются положительные и отрицательные ионы. Если в жидкость поместить электроды подключенные к источнику тока, то эти ионы начнут придут в движение. Один из электродов подключен к отрицательному полюсу источника тока – он называется катод – другой подключен к положительному - анод. При подключении к источнику тока ионы в растворе электролита отрицательные ионы начинают двигаться к положительному электроду (аноду), а положительные – соответственно к отрицательному (катоду). То есть установится электрический ток. Такую проводимость в жидкостях называют ионной, так как носителями заряда являются ионы.
При прохождении тока через раствор электролита на электродах происходит выделение вещества, связанное с окислительно-восстановительными реакциями. На аноде отрицательно заряженные ионы отдают свои лишние электроны (окислительная реакция), а на катоде положительные ионы принимают недостающие электроны (восстановительная реакция). Такой процесс называется электролизом.
При электролизе на электродах происходит выделение вещества. Зависимость массы выделившегося вещества m от силы тока, времени прохождения тока и самого вещества установил М.Фарадей. Этот закон можно получить теоретически. Итак, масса выделившегося вещества равна произведению массы одного иона m i на число ионов N i , достигших электрода за время Dt. Масса иона согласно формуле количества вещества равна m i =M/N a , где M – молярная масса вещества, N a – постоянная Авогадро. Число ионов, достигших электрода, равно N i =Dq/q i , где Dq – заряд, прошедший электролит за время Dt (Dq=I*Dt), q i – заряд иона, который определяется валентностью атома (q i = n*e, где n – валентность атома, e – элементарный заряд). При подстановке этих формул получаем, что m=M/(neN a)*IDt. Если обозначить через k (коэффициент пропорциональности) =M/(neN a), то имеем m=kIDt. Это математическая запись первого закона Фарадея – одного из законов электролиза. Масса вещества, выделившегося на электроде за время Dt при прохождении электрического тока, пропорциональна силе тока и этому промежутку времени. Величину k называют электрохимическим эквивалентом данного вещества, который численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. [k]= 1 кг/Кл. k = M/(neN a) = 1/F*M/n , где F – постоянная Фарадея. F=eN a =9,65*10 4 Кл/моль. Выведенная формула k=(1/F)*(M/n) является вторым законом Фарадея.
Электролиз широко применяется в технике для различных целей, например,так покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, омеднение и др.). Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, то можно получить копию рельефа поверхности. Этот процесс называется гальванопластика. Также при помощи электролиза осуществляют очистку металлов от примесей, например, толстые листы неочищенной меди, полученной из руды, помещают в ванну в качестве анода. В процессе электролиза медь растворяется, примеси выпадают на дно, а на катоде оседает чистая медь. С помощью электролиза ещё получают электронные платы. На диэлектрик наклеивают тонкую сложную картину соединяющих проводов, затем помещают пластину в электролит, где вытравливаются незакрытые краской участки медного слоя. После этого краска смывается и на плате появляются детали микросхемы.

